Neutrophil Extracellular Traps aktivieren das Immunsystem
Max-Planck-Forscher*innen zeigen, dass Neutrophil Extracellular Traps die Immunreaktion durch den Rezeptor cGAS verstärken können

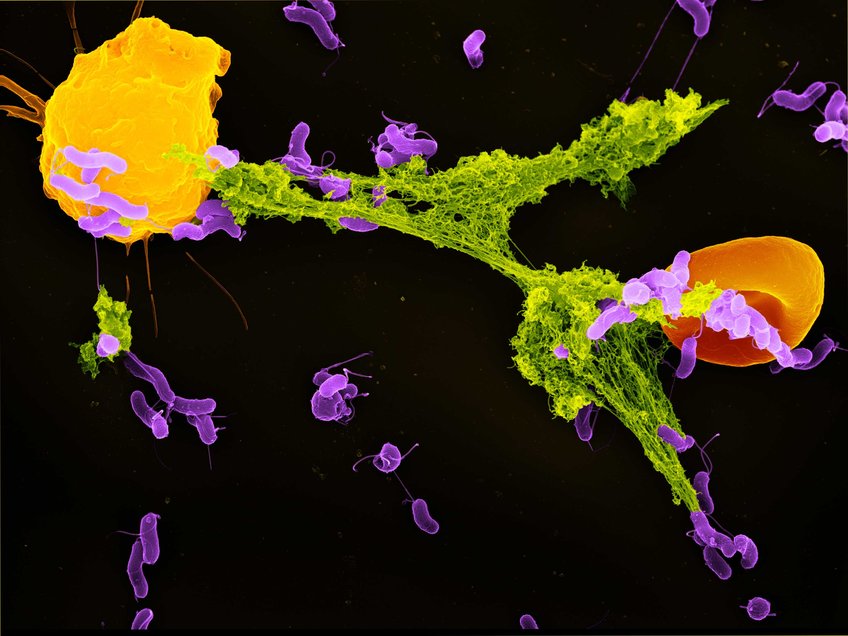
Ein Neutrophiler Granulozyt (gelb) hat sein NET (grün) ausgeworfen, um Bakterien (lila) einzufangen. Auch ein rotes Blutkörperchen (orange) hat sich im NET verfangen. An den klebrigen DNA-Fäden der NETs bleiben die Erreger hängen und werden durch antimikrobielle Stoffe abgetötet. Neu ist, dass die NETs neben dieser direkten Abwehr auch das Immunsystem durch den Rezeptor cGAS aktivieren können. Gefärbte Aufnahme mit Rasterelektronen-Mikroskop von Volker Brinkmann.
Neutrophile sind Zellen des angeborenen Immunsystems. Dringen Erreger in unseren Körper ein, können Neutrophile sie identifizieren und unschädlich machen. Dafür verfügen Neutrophile über verschiedene Abwehrmechanismen – sie können Erreger aufnehmen und verdauen oder antimikrobielle Gifte ausschütten. Die sogenannten Neutrophil Extracellular Traps, kurz NETs, bilden einen dritten Mechanismus: Kommen die Neutrophilen mit Erregern in Kontakt, können sie ihre Zell- und Kernmembran auflösen und netzartige DNA-Strukturen freigeben. An diesen DNA-Fallen bleiben die Erreger kleben und werden durch die gleichzeitige Ausschüttung von antimikrobiellen Substanzen abgetötet. Die dabei zurückbleibende DNA wird abschließend von Fresszellen entsorgt.
NETs aktivieren cGAS – cGAS aktiviert Interferon-Produktion
Durch vorausgegangene Studien gab es Hinweise darauf, dass die Überreste der NETs das Immunsystem weiter aktivieren können. Dieser Signalwirkung ist Falko Apel aus dem Team von Arturo Zychlinsky am Max-Planck-Institut für Infektionsbiologie auf den Grund gegangen: Er konnte zeigen, dass NETs nach der Aufnahme durch Fresszellen an den DNA-Rezeptor cGAS binden. So werden die Fresszellen zur Produktion von Interferonen angeregt – das sind Signalstoffe, die eine verstärkte Immunreaktion anstoßen.
Um den Mechanismus hinter dieser Aktivierung zu verstehen, haben die Forscher*innen zunächst Neutrophile und Fresszellen von gesunden Spender*innen isoliert. In dieser kontrollierten Umgebung konnten sie beobachten, dass die Fresszellen auf die Produktion von NETs reagieren und entzündungsfördernde Signalstoffe ausschütten. Nach diesem Ergebnis wollte das Team dann herausfinden, welche Rezeptoren in oder auf den Fresszellen die NETs erkennen. Dazu haben sie Fresszellen mithilfe der Genschere CRISPR/Cas9 genetisch verändert und so Rezeptoren ausgeschaltet, die DNA – den Hauptbestandteil von NETs – erkennen können. Beim Rezeptor cGAS kam dann der Treffer: War dieser Rezeptor inaktiv, reagierten die Fresszellen nicht mehr auf NETs.
Wie kommen NETs und cGAS zusammen?
Die darauffolgenden Versuche waren eine Spurensuche. „NETs entstehen extrazellulär – cGAS befindet sich aber im Inneren der Fresszellen,“ so Falko Apel, Erstautor der Studie. „Darum wollten wir herausfinden, wie cGAS und NETs zusammenkommen.“ In ihren Experimenten haben die Wissenschaftler*innen den Weg der NETs nachgverfolgt: Fresszellen nehmen die DNA-Reste in ihrem Phagosom auf, einem abgeschlossenen Zellkompartiment, das Zellreste verdauen kann. Anstatt verdaut zu werden, entwischen die NETs aber ins Zellinnere, wo sie vom Rezeptor cGAS entdeckt werden. Der Rezeptor stößt dann die Produktion von Typ I Interferonen an – entzündungsfördernden Signalstoffen, die das Immunsystem aktivieren. Da Neutrophile oft die ersten Immunzellen sind, die auf Erreger reagieren, ist eine Aktivierung des Immunsystems hilfreich, um weitere Zellen für die Abwehr zu rekrutieren.
Schattenseiten der Immun-Aktivierung
Die entzündungsfördernde Wirkung von NETs hat jedoch auch Schattenseiten. Wissenschaftler*innen ziehen Verbindungen zwischen der Aktivierung des Immunsystems durch NETs und Autoimmunerkrankungen. Das sind Krankheiten bei denen sich das Immunsystem gegen den eigenen Körper richtet und chronische Entzündungen auslösen kann, wie zum Beispiel systemischer Lupus Erythematodes oder rheumatoide Arthritis. Patient*innen mit diesen Krankheiten haben eine erhöhte Menge NETs und eine hohe Konzentration von Typ I Interferonen im Blut.
Das verleiht der Veröffentlichung von Falko Apel und seinen Kolleg*innen eine besondere Gewichtung. Sie haben einen grundlegenden Mechanismus zwischen NETs und der Ausschüttung von Typ I Interferonen aufgedeckt. Das könnte dabei helfen, die negative Seite von NETs bei chronischen Entzündungen zu erklären und einen neuen Ansatz für Therapien schaffen. Bislang setzt man auf Therapien, die auf einer breiten Unterdrückung des Immunsystems basieren – mit vielen Nebenwirkungen. Neue Therapien, die sich gegen GAS richten, könnten die unerwünschte Aktivierung des Immunsystems gezielt verhindern.