Rationale Entwicklung eines Tuberkulose-Impfstoffs: Vom Reißbrett zur klinischen Studie
Forschungsbericht (importiert) 2015 - Max-Planck-Institut für Infektionsbiologie
Beschreibung
Tuberkulose gehört nach wie vor zu den größten globalen Gesundheitsproblemen. Im Jahr 2014 führte die Krankheit die Liste der tödlichen Infektionen mit 9,6 Millionen Krankheitsfällen und 1,5 Millionen Todesfällen weltweit an [1]. Dabei ist die HIV-TB-Koinfektion besonders besorgniserregend, denn sie forderte im selben Jahr knapp eine halbe Million Todesopfer. Die Kleinkind-TB wird bislang unterschätzt, obwohl mindestens eine Million Kinder jährlich an TB erkranken, von denen über 140.000 sterben. Auch die zunehmende Multiresistenz des TB-Erregers, Mycobacterium tuberculosis (Mtb), ist erschreckend. Knapp eine halbe Million Menschen erkrankten 2014 an multiresistenter TB, von denen jeder Zweite verstarb.
Bacille-Calmette-Guérin (BCG) ist ein attenuierter Lebendimpfstoff, der seit 1924 zur Prävention der Kleinkind-TB eingesetzt wird und mit 4 Milliarden Administrationen heute der meist verabreichte Impfstoff ist [2]. Zwar schützt BCG gegen extrapulmonäre Formen der TB in Kleinkindern; gegenüber der am häufigsten vorkommenden Lungen-TB in allen Altersgruppen ist er jedoch weitgehend machtlos. Ein in unserem Labor entwickelter neuer Impfstoff, der sich im fortgeschrittenen Stadium der klinischen Überprüfung befindet, könnte diesen Bedrohungen Einhalt gebieten.
Immunantwort gegen Mtb
Mtb wird durch Aerosole übertragen, sodass die Lunge die wichtigste Eintrittspforte des Erregers darstellt [3]. Obwohl nicht auszuschließen ist, dass der Erreger in wenigen Fällen durch die angeborene Immunität direkt eliminiert wird, kommt es in den meisten Fällen zu einer stabilen Infektion, die durch das erworbene Immunsystem in Schach gehalten wird (Abb. 1). Geschätzte zwei Milliarden Menschen sind latent mit Mtb infiziert; sie tragen also den Erreger lebenslang in sich, bleiben aber gesund. Bei etwa 5 bis 10 % dieser latent Infizierten bricht zu einem späteren Zeitpunkt die Krankheit aus, wenn der Erreger der Immunkontrolle entkommt. Die erworbene spezifische Immunität gegen TB wird von T-Lymphozyten vermittelt und von Makrophagen ausgeführt. Nicht nur für den Schutz, sondern auch für die Pathologie sind diese beiden Zell-Populationen mit verantwortlich. Schon bald nach der Infektion entstehen Granulome, in denen sich Makrophagen, Granulozyten, dendritische Zellen, T-Lymphozyten und B-Lymphozyten organisieren. In diesen Granulomen bleibt der Erreger eingekapselt, sodass der Krankheitsausbruch verhindert werden kann.
Durch fehlgeleitete Immunität kommt es zum Zusammenbruch des soliden Granuloms, das nachfolgend eine käsige Konsistenz annimmt [4]. Das käsige Granulom bietet den geeigneten Nährboden für Mtb und schädigt massiv das Lungengewebe: Eine offene TB hat sich entwickelt, die unbehandelt häufig tödlich verläuft. Der Patient ist in diesem Stadium hoch ansteckend.
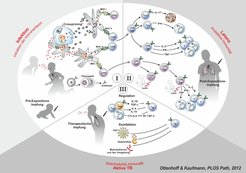
Abb. 1: Übersicht über die Immunantwort bei der Tuberkulose.
(I) Mycobacterium tuberculosis (Mtb) wird durch Aerosole übertragen. Der Erreger gelangt in die Alveolar-Räume der Lunge, von wo er von Makrophagen (Mɸ) und dendritischen Zellen (DC) in drainierende Lymphknoten verschleppt wird. Dort werden mykobakterielle Antigene von diesen Zellen prozessiert und T-Lymphozyten präsentiert. Hierbei werden antigene Peptid-Bruchstücke von Präsentationsmolekülen des Haupthistokompatibilitätskomplexes (major histocompatibility complex (MHC)) der Klasse II den CD4 T-Lymphozyten (CD4) angeboten, während über MHC-I Präsentation CD8 T-Lymphozyten (CD8) stimuliert werden. Daneben werden auch B-Zellen (B) stimuliert, zu Plasmazellen heranzureifen, die Mtb spezifische Antikörper bilden. Eine Impfung von Kleinkindern, die noch nicht mit Mtb infiziert sind, wird als Prä-Expositions-Impfung bezeichnet.
(II) Die CD4 und CD8 T-Zellen entwickeln sich zu Effektor-T-Zellen (Teff). Die CD4 T-Zellen sind charakteristischerweise T- Helfer-Zellen (Th), das heißt, sie produzieren Zytokine, die andere Immunzellen anlocken und aktivieren. Für die Abwehr der Tuberkulose (TB) werden in erster Linie Th1-Zellen benötigt, die das Mɸ aktivierende Inteferon-ɣ (IFN-ɣ) als Leitzytokin produzieren. Daneben werden auch Th17-Zellen stimuliert, die über das Zytokin Interleukin-17 (IL-17) polymorphkernige neutrophile Graunulozyten (PNG) aktivieren. Weiterhin entwickeln sich langlebige Gedächtnis-T-Zellen (TM), die mehrere Zytokine wie IL-2, IFN-ɣ und Tumor-Nekrose-Faktor (TNF) gleichzeitig sezernieren können und so die zelluläre Immunabwehr koordinieren. Die CD8 T-Lymphozyten reifen zu T-Effektorzellen heran, die zytolytische Funktionen besitzen (sogenannte zytolytische T-Lymphozyten (CTL)). Sie können Mtb infizierte Makrophagen zerstören. Auch die CD8 T-Zellen entwickeln sich zu Gedächtnis-T-Zellen (CD8 TM), die ähnlich wie die CD4 TM unterschiedliche Zytokine produzieren, daneben aber auch ihre zytolytische Aktivität beibehalten. Das Endergebnis des Wechselspiels zwischen T-Zellen und Makrophagen ist die Bildung von soliden Granulomen, in denen der Erreger eingekapselt wird. Die Person bleibt latent infiziert und entwickelt keine aktive Tuberkulose. In hoch endemischen Gebieten ist der weitaus größte Anteil der erwachsenen Bevölkerung latent mit Mtb infiziert. Eine Impfung dieser infizierten, aber gesunden Population wird als Post-Expositions-Impfung bezeichnet.
(III) Kommt es zu einer Schwächung der Immunantwort, nekrotisiert das Granulom, da Wirtszellen vermehrt absterben. Es entwickelt sich ein käsiges Granulom, das einen ausgezeichneten Nährboden für die Erreger bietet, die nun zu hoher Dichte heranwachsen. Durch Reaktivierung entsteht aus der latenten Mtb-Infektion eine aktive TB-Erkrankung. Die der Reaktivierung zugrundeliegenden Mechanismen sind bislang noch nicht vollständig verstanden. Koinfektion mit dem Humanen Immundefizienz-Virus (HIV) ist ein häufiges Ereignis, das aufgrund der Schwächung der CD4 T-Lymphozyten zur TB-Reaktivierung führt. Auch Infektionen mit Helminthen oder Mykobakterien aus der Umgebung können die immunologischen Abwehrkräfte gegen TB schwächen. Helminthen stimulieren in erster Linie T-Helfer-Zellen vom Typ 2 (Th2), die unter anderem über die Produktion von IL-4 und IL-10 Th1-Zellen supprimieren. Auch regulatorische T-Zellen (Treg) können durch inhibitorische Zytokine (in erster Linie IL-10 und TGF-β (von transforming growth factor, transformierender Wachstumsfaktor)) schützende T-Zellen blockieren. Neben diesen Zytokin-vermittelten Effekten kommen auch Zell-Zell-Interaktionen zwischen Mɸ und DC auf der einen und T-Zellpopulationen auf der anderen Seite in Frage. Hierzu gehören zum Beispiel die Interaktionen zwischen den CTLA-4 und B7-Korezeptorensystemen. Diese direkten Zell-Zell-Interaktionen werden als „Checkpoint Control“ bezeichnet. Sie sollen im Normalfall überschießende Immunreaktionen vermeiden, können aber bei zu starker Hemmwirkung auch schädliche Folgen hervorrufen. Als Impfung von TB-Kranken in Ergänzung zur Chemotherapie kommt eine therapeutische Impfung in Frage.Entwicklung neuer TB-Impfstoffe
Mit der zunehmenden Erkenntnis, dass der herkömmliche BCG Lebendimpfstoff wenig gegen die Lungen-TB bewirken kann, wurden neue Impfstrategien entwickelt, die auf zwei Standbeinen beruhen [2]. Das erste umfasst Spaltvakzine, die als Booster die Immunantwort durch BCG verbessern sollen. Zum zweiten Standbein zählen verbesserte Lebendimpfstoffe, die BCG ersetzen sollen. Auch die Kombination beider Strategien ist denkbar. In unserem Labor wurde ein rekombinanter BCG-Impfstoff entwickelt, der eine stärkere Immunantwort hervorruft (Abb. 2).
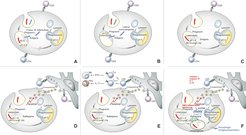
Abb. 2: Übersicht über die Mechanismen, die zu einer verbesserten Immunogenität des rekombinanten BCG-Impfstoffs r-BCG ΔureC::hly führen.
(A) Ein erster Schritt bei der Präsentation bakterieller Antigene ist die Keimphagozytose durch Makrophagen. Durch Phagozytose gelangen die Keime in das frühe Phagosom. Mtb besitzt die Fähigkeit, aus dem Phagosom in das Zytosol zu entweichen. Antigene in diesem Kompartiment stimulieren CD8 T-Lymphozyten (CD8). Antigene im Phagosom werden CD4 T-Lymphozyten (CD4) präsentiert. BCG verbleibt im Phagosom und kann daher lediglich CD4 T-Zellen stimulieren.
(B) Listeria monocytogones besitzt die Fähigkeit, aus dem Phagosom auszuwandern. Hierfür verantwortlich ist Listeriolysin (Hly), das im sauren Milieu (pH 5,5) die Phagosomenmembran perforieren kann. Daher werden Antigene, die von L. monocytogones im Zytosol gebildet werden, CD8 T-Lymphozyten angeboten.
(C) In den Impfstamm r-BCG ΔureC::hly wurde das Hly-kodierende Gen im Austausch durch eine Urease-C (UreC) Gendeletion integriert. Die UreC neutralisiert den pH-Wert des Phagosoms durch Ammoniumbildung. Ihr Fehlen fördert die Ansäuerung des Phagosoms, sodass das von r-BCG ΔureC::hly produzierte Hly seine biologische Aktivität entfalten kann. Antigene des Impfkeims gelangen in das Zytosol und können so CD8 T-Zellen stimulieren. Daneben werden auch CD4 T-Lymphozyten stimuliert, da der Impfkeim selbst im Phagosom verbleibt.
(D) Die Ansäuerung des Phagosoms fördert auch die Phagolysosomenbildung. Auf diese Weise gelangen lysosomale Enzyme in das Phagolysosom. Austritt bestimmter lysosomer Enzyme (Kathepsine) aus dem Phagolysosom in das Zytosol führt zur Apoptose der Wirtszellen. Es entstehen apoptotische Vesikel, in denen Antigene des Impfkeims angereichert sind. Diese werden von dendritischen Zellen (DC) im Umfeld aufgenommen, die als hoch potente antigenpräsentierende Zellen eine effizientere Immunantwort stimulieren können. Sowohl CD4 als auch CD8 T-Zellen werden auf diese Weise aktiviert.
(E) Die apoptotischen Vesikel enthalten nicht nur Proteinantigene, sondern auch stimulatorische Moleküle, die die Aktivierung von Th1 und auch Th17 T-Zellen fördern. Auf diese Weise werden nicht nur Makrophagen über Interferon-ɣ (IFN-ɣ), sondern auch polymorphkernige neutrophile Granulozyten (PNG) über Interleukin-17 (IL-17) stimuliert.
(F) Zusätzlich kommt es auch zur Inflammasom-Aktivierung. Durch die Poren des Phagosoms gelangt doppelsträngige DNA (dsDNA) des Impfkeims in das Zytosol, die vom intrazellulären Sensor AIM-2 erkannt wird. Dies stimuliert die Enzyme Caspase-1 sowie Caspase-3/7, welche IL-1 und IL-18 aus ihren Vorstufen generieren. Daneben leitet die Erkennung der dsDNA durch AIM-2 sowie durch den Sensor STING die Bildung eines Autophagosoms ein, das durch das Markermolekül LC-3 II detektierbar ist. Prozessierungen von Antigenen des Impfkeims im Autophagosom tragen zur verbesserten Antigenpräsentation und T-Zellstimulation bei.Intrazelluläre Bakterien wie Mtb oder Listeria monocytogenes, aber auch der Impfstamm BCG werden nach Eintritt in den Wirtsorganismus von professionellen antigenpräsentierenden Zellen, insbesondere Makrophagen und dendritischen Zellen, durch Phagozytose aufgenommen und gelangen in der Wirtszellen in ein frühes Phagosom. Von dort aus schlagen sie unterschiedliche Wege ein. L. monocytogenes durchbricht die Membran des Phagosoms und entweicht in das Zytosol. Mit Verzögerung folgt auch Mtb diesem Weg. BCG hingegen verbleibt im Phagosom. Wir haben in das Genom des BCG-Impfstoffs ein Gen von Listeria monocytogenes eingepflanzt, das das porenbildende Hämolysin (Hly) Listeriolysin-O kodiert. Hly ermöglicht es den Listerien, die Phagosomen-Membran zu perforieren und dadurch aus dem Phagosom in das Zytosol der infizierten Wirtszelle zu entweichen [5]. Ein funktionell vergleichbares porenbildendes System besitzt auch Mtb. Dessen System ist jedoch weit komplexer aufgebaut und ist noch ungenügend verstanden. Da BCG das porenbildende System fehlt, wird es im Phagosom eliminiert. Hly ist nur im sauren Milieu aktiv. BCG besitzt jedoch die Fähigkeit, das Milieu im Phagosom neutral zu halten, woran das Enzym Urease-C beteiligt ist. Um einen optimalen pH-Wert für Hly zu erzielen, wurde daher das Gen für Urease-C im Impfstamm deletiert. Der nun generierte Impfstamm r-BCG ΔureC::hly ermöglicht die Ansäuerung des Phagosoms, die für die biologische Aktivität des Hly benötigt wird. Durch Perforation der Phagosomen-Membran entweichen Antigene in das Zytosol und stimulieren nach entsprechender Prozessierung CD8 T-Lymphozyten. Da der Impfstamm selbst im Phagosom verbleibt, wo er zügig eliminiert wird, kommt es auch zu einer deutlichen Stimulation von CD4 T-Lymphozyten. Das saure Milieu des Phagosoms ermöglicht die Fusion mit Lysosomen, sodass lysosomale Enzyme durch die perforierte Membran in das Zytosol austreten und Apoptose und Autophagie auslösen [6]. Diese Mechanismen tragen ebenfalls zur verbesserten T-Lymphozyten-Stimulation bei. In der Tat werden die für den Schutz benötigten zentralen Gedächtnis-T-Zellen bevorzugt aktiviert [7]. Somit aktiviert der Impfstamm zahlreiche Mechanismen, die die Immunogenität und Effektivität verstärken.
Präklinische und klinische Untersuchungen
Der Impfstamm r-BCG ΔureC::hly schützt Mäuse gegen einen Mtb-Laborstamm und ein klinisches Isolat [5]. In beiden Fällen ist der Schutz deutlich besser als der durch BCG hervorgerufene. Auch zeigt der neue Impfstoff in verschiedenen Tiermodellen generell ein deutlich besseres Sicherheitsprofil als BCG [8].
Nach erfolgreichem Abschluss der Präklinik wurde der Impfstoff in einer klinischen Phase I-Studie (Registriernummer NCT 00749034) an Erwachsenen in Deutschland überprüft [9]. Der rekombinante Impfstoff erwies sich als sicher und wurde von den Studienteilnehmern gut toleriert. Auch war er immunogen und stimulierte antigenspezifische T-Zellantworten. Anschließend wurde der Impfstoff an Erwachsenen in einem endemischen Gebiet in Südafrika auf Sicherheit und Immunogenität überprüft (Registriernummer NCT01113281). Auch diese Studie konnte erfolgreich abgeschlossen werden. In beiden Studien wurden sowohl Teilnehmer getestet, die zuvor eine BCG-Impfung erhalten hatten, als auch solche, die nicht mit BCG geimpft waren. Somit ist der Impfstoff sowohl im Austausch für BCG als auch als Booster einer früheren BCG-Impfung denkbar. Anschließend wurde der Impfstoff in neugeborenen Kindern als wichtige Zielgruppe in einer klinischen Phase IIa Studie geprüft (Registriernummer NCT 01479972). Auch hier erwies sich der Impfstoff als sicher und immunogen. Aufgrund dieser ermutigenden Befunde wurde im Jahr 2015 eine groß angelegte Impfstudie mit Kleinkindern von Müttern mit HIV-Infektion begonnen (Registriernummer NCT02391415). Auf diese Weise soll festgestellt werden, ob der neue Impfstoff auch in HIV exponierten Neugeborenen sicher ist. Aufgrund vereinzelter Zwischenfälle bei der BCG-Impfung von HIV exponierten Neugeborenen wird in Südafrika die BCG-Impfung von Säuglingen mit nachgewiesener HIV-Infektion nicht empfohlen. Wegen des hohen Sicherheitsprofils in präklinischen Studien besteht begründete Hoffnung, dass der neue Impfstoff auch in HIV exponierten Kleinkindern zum Schutz gegen TB eingesetzt werden kann.
Der Impfstoff wurde an die Vakzine Projekt Management GmbH lizenziert, die die klinischen Impfstudien betreut. Kürzlich wurde der Impfstoff an das Serum Institut von Indien (SII) sub-lizenziert, dem nach Dosen gerechnet größten Impfstoff-Hersteller der Welt mit einem breiten Impfstoff-Portfolio. Mit diesem Konsortium ist für 2016 in Indien eine groß angelegte Phase III-Studie an einer TB-Hochrisikogruppe geplant. Dies sind erwachsene TB-Patienten, die nach abgeschlossener Chemotherapie als geheilt entlassen werden. Rund 5% bis 10% dieses Personenkreises erkranken erneut an TB, entweder weil sie sich nach der Behandlung neu infiziert haben oder aber weil der ursprüngliche Mtb-Erreger durch die Behandlung nicht vollständig eliminiert wurde. Somit handelt es sich um eine sogenannte Postexpositions-Impfung , also eine prophylaktische Studie an Erwachsenen, die bereits eine Mtb-Infektion durchgemacht haben (siehe auch Abb. 1). Diese Studie soll in erster Linie die Effektivität des neuen Impfstoffs ermitteln. Auch wenn diese Studie über mehrere Jahre angelegt ist, besteht große Hoffnung, dass mit einem effektiven Impfstoff gegen die Lungen-TB in allen Altersgruppen eines der größten globalen Gesundheitsprobleme, besonders für Entwicklungsländer und Schwellenländer, eingedämmt werden kann. So könnte das Ziel der Weltgesundheitsorganisation erreicht werden, von 2015 bis 2035 Krankheitsfälle und Todesfälle durch TB um 90 bzw. 95% zu senken.
Hinweis: Bei dem hier vorliegenden Text handelt es sich teilweise um die freie Übersetzung eines Teils der von Kaufmann et al. veröffentlichten Arbeit in der internationalen Zeitschrift Expert Review of Vaccines [8].

