Chronische Infektionen des Magens und deren fatale Folgen
Forschungsbericht (importiert) 2017 - Max-Planck-Institut für Infektionsbiologie
Ein neues Prinzip der Erregererkennung
Helicobacter pylori ist einer der verbreitetsten bakteriellen Erreger. Er besitzt die erstaunliche Fähigkeit, lebenslang im Magen zu verharren. Die Betroffenen leiden dann häufig an schmerzhafter Magenschleimhautentzündung, deren Ausmaß je nach Erregereigenschaft und Disposition des Patienten variiert. Es wird zwischen zwei Erregertypen unterschieden: Den harmloseren Varianten fehlt ein wichtiges Pathogenitätsprinzip, das sogenannte cagPAI-Typ-4-Sekretionssystem (T4SS), das den gefährlicheren, entzündungsfreudigen Erregervarianten zur Einschleusung des CagA-Proteins in infizierte Zellen dient. Das eingeschleuste Protein setzt komplexe zelluläre Prozesse in Gang, die mit der Entstehung von Magenkrebs in Verbindung gebracht werden.
Neue Arbeiten ergaben nun, dass die Entzündungsreaktion nicht vom translozierten CagA-Protein selbst herrührt, sondern vielmehr von einem Zuckermolekül, das in winzigen Mengen, quasi en passant, durch die geöffnete Schleuse ebenfalls in die Wirtszellen gelangt. Es handelt sich um eine doppelt phosphorylierte Heptose (HBP), die viele Gram-negative Bakterien als Intermediat zur Lipopolysaccharid (LPS)-Synthese verwenden. Dieses Zuckermolekül wird von einem noch unbekannten Rezeptor erkannt und führt zur Aktivierung der bislang wenig bekannten α-Kinase 1 (Alpk1), die eine Phosphorylierung von TIFA bewirkt, dem nächsten Protein in der proinflammatorischen Signalkette. Der Entzündungsprozess setzt innerhalb weniger Minuten nach Infektion ein, wobei unter dem Mikroskop große Signalkomplexe (TIFAsomen) sichtbar werden, die mehrere Stunden lang stabil bleiben und den Transkriptionsfaktor NF-κB zur Translokation in den Zellkern infizierter Zellen veranlassen. Dort angelangt bewirkt NF-κB die Bildung eines Cocktails inflammatorischer Zytokine, beispielsweise Interleukin 8. Die Zytokine werden in das angrenzende Gewebe ausgeschüttet und lotsen entzündungsfördernde Blutzellen zum chronischen Infektionsherd [1].
Eine Folge von Cholesterolentzug
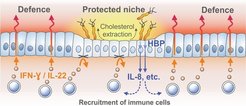
Erstaunlich ist, dass allein schon die Intensität der Entzündung zur vollständigen Abwehr der Erreger führen müsste – stattdessen tendiert der Erreger dazu, lebenslang in der Magenschleimhaut zu persistieren. Bereits 2006 entdeckten die Forscher einen Mechanismus, den Helicobacter zur Modulation der Immunantwort des Wirtsorganismus nutzt. Er beruht auf der Bildung eines Enzyms, das über eine Glukosylierungsreaktion das Cholesterol infizierter Zellen in die Erregermembran überführt [2]. Dadurch verlieren infizierte Epithelzellen letztlich ihr gesamtes Cholesterol. In ihren jüngsten Versuchen konnten die Forscher überraschenderweise feststellen, dass infolge der Cholesterol-Extraktion bestimmte Rezeptoren, deren Aktivierung von sogenannten lipid rafts in der Zellmembran abhängt, auf starke entzündliche Reize nicht mehr reagieren. Es handelt sich dabei um die Rezeptoren der zentralen Botenstoffe Interferon-γ und Interleukin-22, die Entzündungssignale aktivierter Immunzellen an das Epithel übermitteln, um die Bildung antibakterieller Stoffe wie beispielsweise Defensine auszulösen. So konnten die infizierten Epithelzellen keine antibakteriellen Stoffe mehr bilden und die Erreger waren an diesen Stellen auf der Schleimhaut geschützt – ein Mechanismus, der offenbar lebenslang anhält (Abb. 1).
Die Homöostase der gastrischen Drüsen ist gestört
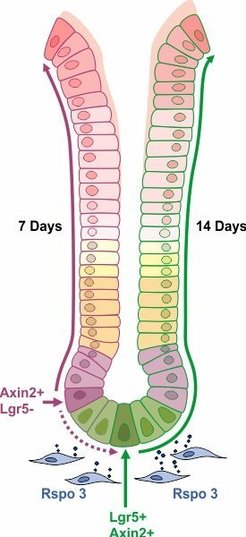
Obgleich damit ein zentraler Aspekt der Erregerpersistenz erkannt war, kommen bei einer Infektion der Magenschleimhaut noch weitere Regelmechanismen zum Tragen. Die gesamte Schleimhautoberfläche ist von einem einschichtigen, epithelialen Drüsengewebe umkleidet, das unter anderem Magensäure bildet. Zum Schutz gegen die Säure prägen die Zellen auf ihrer Oberfläche eine Schleimschicht aus. Außerdem werden diese Zellen stetig regeneriert, sodass sich das Drüsenepithel innerhalb von zwei Wochen erneuert. Dies geschieht auf der Grundlage von Stammzellen, die sich an der Basis der gastrischen Drüsen befinden und den Rezeptor Lgr5 tragen. Lgr5 wiederum ist wichtig für die Aktivierung des Wnt-Signalweges, der beispielsweise den Faktor Axin-2 reguliert; so haben Axin-2 positive Zellen den Wnt Signalweg angeschaltet. Die Max-Planck-Forscher konnten nun zeigen, dass sich in der Nähe der Lgr5-Stammzellen noch weitere, ebenfalls Axin-2-positive-Stammzellen aufhalten, die zwar kein Lgr5 ausprägen, aber dennoch auf den Wnt-Botenstoff R-spondin stark reagieren und zur Teilung angeregt werden. Dieser morphogene Faktor wird bei einer Helicobacter-Infektion verstärkt gebildet und bewirkt so eine erhöhte Regeneration der Drüsen. Wie die Forscher zeigten, werden die Drüsen in Abwesenheit von R-spondin sehr viel stärker vom Erreger befallen und umgekehrt, nämlich bei externer R-spondin-Zugabe, fast gänzlich von Helicobacter befreit. Diese Beobachtungen belegen erstmals einen grundlegenden Zusammenhang zwischen Geweberegeneration und Erregerabwehr (Abb. 2, [3]). Außerdem ist diese Arbeit beispielhaft für die erstaunliche Plastizität des epithelialen Schleimhautgewebes mit wechselseitiger Zuständigkeit von Lgr5+ und Lgr5- Zellen.
Implikationen und Ausblicke
In ihrer Gesamtheit vermitteln die gewonnenen Einblicke ein kohärentes Bild über die wechselseitigen Bedingungen einer chronisch-entzündlichen Infektion. Dass H. pylori einerseits starke Entzündungen im Umkreis des Infektionsgeschehens auslöst, andererseits aber darin für sich selbst eine geschützte Nische bildet, um dort über Jahrzehnte zu persistieren, eröffnen überraschende Einblicke in mögliche molekulare und zelluläre Voraussetzungen für die Entstehung von Krebs. Das hohe entzündliche Potential, verbunden mit der beschleunigten Zellregeneration und einem gestörten Gleichgewicht bei der Stammzellregeneration, könnte zu einer unerwünschten Häufung von Mutationen führen und eine Krebsentwicklung begünstigen. Die Beobachtungen ergeben auch Anhaltspunkte darüber, wie chronisch-bakterielle Infektionen der menschlichen Schleimhaut auch in anderen Körperregionen Krebs begünstigen könnten.

